千葉大学大学院医学研究院の小坂健太朗特任講師、三川信之教授らの研究グループは、京都大学iPS細胞研究所(CiRA)の江藤浩之教授(千葉大学ヒト免疫疾患治療研究・開発センター特任教授、前千葉大学大学院医学研究院教授)らの研究グループと共同で、ヒトiPS細胞(注1)から誘導した血小板産生細胞である巨核球と血小板の混合製剤が糖尿病マウスの創傷治癒を促進することを示しました。さらに、フリーズドライ化によってその効果を長期間維持できることを明らかにしました。
この成果により、患者さん自身の血小板を用いた従来の治療法と比べて、負担が少なく安定して高い効果を発揮する難治性潰瘍(注2)の治療薬開発が期待されます。
本研究成果は、2024年10月14日に、学術誌Stem Cell Research & Therapyでオンライン公開されました。
■研究の背景
糖尿病や重症下肢虚血、膠原病などを原因とする難治性潰瘍の患者数は、増加の一途をたどっています。創部の感染により下肢の切断などを余儀なくされる場合もあり、QOLの低下や生命予後の悪化につながります。皮膚潰瘍の新しい治療法として、患者さんの血液に含まれる血小板を濃縮して創部に投与する多血小板血漿(Platelet Rich Plasma: PRP)療法が試みられていますが、その有効性と安全性はいまだに確立されていません。科学的には、血小板から放出される多様な生理活性物質に含まれる成長因子(注3)が創部の環境を改善し治癒を促すと推測されていますが、その作用メカニズムは十分に明らかになっていません。さらに、PRPの調製には患者さん自身から採取した血液を用いるため、採血にともなう負担や、合併症により実施できない可能性などの問題もあります。また、血小板に含まれる成長因子の濃度は個人差が大きく、安定した効果が得られにくいといった点も指摘されています。
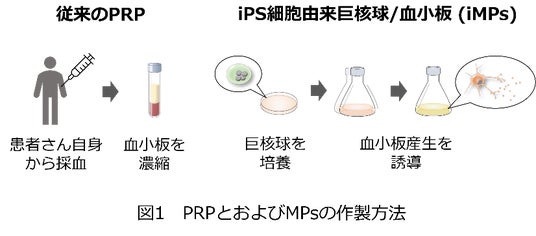
研究グループは以前、iPS細胞から分化させた血液前駆細胞に3種類の遺伝子を発現させ、巨核球細胞を不死化(注4)しました参考文献1)。これにより、巨核球細胞を大量に増殖させ、そこから膨大な数の血小板を製造することに成功しました。これらの細胞を難治性潰瘍の治療に応用し、iPS細胞由来巨核球および血小板の混合製剤(iPSCs-derived Megakaryocytes and Platelets: iMPs)(図1)の創傷治癒促進効果を検証しました。
■研究の成果
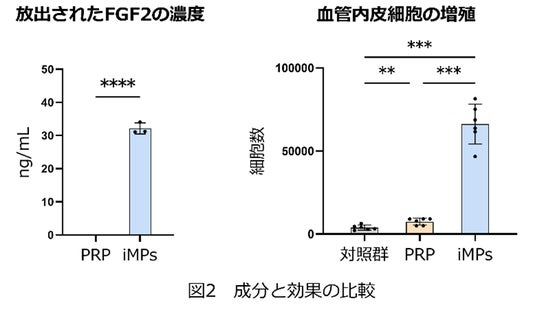
研究グループはまず、iMPsから放出される成長因子の濃度を測定し、従来のPRPと比較しました。複数の創傷治癒を促進する代表的な成長因子が、iMPsとPRPの両方から高濃度で検出されました。しかし、有効な成長因子のひとつであるFGF2(注5)は、PRPからは検出されず、iMPsのみで検出されました(図2左)。同じヒト血小板を含むiMPsとPRPですが、放出される成長因子は部分的に異なっていることが分かりました。
次に、創傷治癒において重要な役割をもつ線維芽細胞と血管内皮細胞に対してiMPsがおよぼす影響を検証しました。iMPsは、線維芽細胞の増殖を促進するだけでなく、線維芽細胞自体からの成長因子産生能力を上昇させました。このことは、iMPsが創傷治癒の進行に欠かせない細胞間コミュニケーションを促す可能性を示しています。また、iMPsは血管内皮細胞の増殖も促進しましたが、その効果は従来のPRPと比べ8.8倍でした(図2右)。
このような大きな違いが生じた原因として、研究グループはiMPsのみで検出された成長因子FGF2に着目しました。実際に、FGF2は単独でも血管内皮細胞の増殖を促進することが確認されました。そこで、FGF2の効果を阻害する薬剤を血管内皮細胞に投与したところ、iMPsの効果が低下しました。これらの結果は、iMPsがFGF2を放出することで、PRPと比べて血管内皮細胞の増殖を強く促進し、創部の血流をより向上させた可能性を示唆します。さらにRNA-seq法(注6)によって、FGF2以外にもANGPTL4という血管形成に欠かせない遺伝子への刺激などが、iMPsが血管内皮細胞の増殖を促進するメカニズムであることが分かりました。
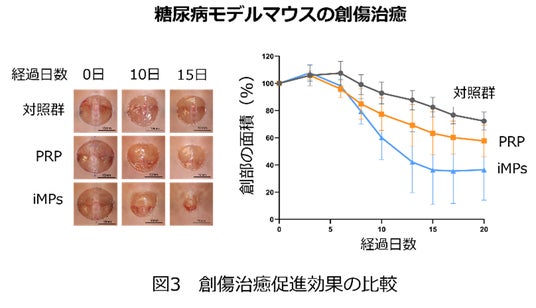
糖尿病は、難治性潰瘍の原因として頻度の高い疾患の一つです。研究グループは、糖尿病マウスの背部に皮膚潰瘍を作成し、iMPsもしくはPRPを創面に投与して経過を観察しました。その結果、投与の10日後にはどちらも対照群と比べて創部の面積が縮小していました。また13日目以降では、iMPsを投与した群はPRPを投与した群よりも創部が縮小しており、iMPsがPRPを上回る効果を示しました(図3)。皮膚組織を採取して染色標本を観察すると、創部におけるコラーゲンの合成や血管の形成がiMPsによって促進されていることが分かりました。iMPsはPRPよりも多くの血管形成を誘導していましたが、この結果は血管内皮細胞の増殖促進効果の違いを反映していました。
最後に、将来的な臨床応用を見据えて、研究グループはiMPsを凍結乾燥することで長期保存や輸送への適応を試みました。粉末状に加工したフリーズドライ化iMPs(図4)を3か月間4℃で保管し、蒸留水に溶かして成長因子の濃度を測定しました。その結果、加工していない通常のiMPsよりもさらに高い濃度の成長因子がフリーズドライ化iMPsから検出されました。またそれらを糖尿病マウスの皮膚潰瘍に投与したところ、通常のiMPsと同等の創傷治癒促進効果が確認されました。この結果により、凍結乾燥はiMPsの長期保存や輸送を可能にし、製剤化に向けての有効な手法であることが示されました。

■今後の展望
本研究により、これまで患者さん自身の血液を必要としていた血小板投与による難治性潰瘍の治療が、iPS細胞から誘導した巨核球細胞と血小板で代替できる可能性が示されました。不死化した巨核球細胞は高い増殖能を持つため、大量生産にも適していると考えられます。今後は、患者さんのQOLと生命予後の向上に寄与する新規治療薬の開発につながることが期待されます。
■用語解説
注1) iPS細胞:さまざまな細胞に分化する能力を持つ多能性幹細胞の一種。皮膚や血液などの体の細胞から作製することができる。
注2) 難治性潰瘍:皮膚が深部まで欠損した状態を潰瘍と呼び、何らかの原因により治癒が通常どおりに進行せず数週間~数ヶ月以上遷延した場合を難治性潰瘍と呼ぶ。
注3) 成長因子:生体内で特定の細胞の増殖や分化を促進する内因性のタンパク質の総称。標的細胞の表面の受容体タンパク質に特異的に結合することにより、細胞間のシグナル伝達物質として働く。
注4) 不死化:一般的に細胞が分裂できる回数は有限であるが、増殖を促進するタンパク質を発現させることなどにより、その制限を超えて無限に増殖できる状態にすること。
注5) FGF2:FGF(線維芽細胞増殖因子)は組織の発達と修復に関連するヘパリン結合タンパク質であり、24種類のFGFファミリーが同定されている。FGF2は強力な血管新生促進作用を有し、皮膚潰瘍の治療薬として製剤化されている。
注6) RNA-seq法:近年開発された次世代シーケンサーと呼ばれる装置を用いて、細胞や組織における遺伝子の発現状態を網羅的に解析する手法。
■研究プロジェクトについて
本研究は以下の研究助成金を受けて実施されました。
・日本学術振興会(JSPS):基盤研究(S)(21H05047S)、若手研究(JP21K16921)、基盤研究(C)(JP23K09095)
・テルモ生命科学振興財団:2019年度開発助成(2)再生医療開発
・京都大学第8回インキュベーションプログラム
・SBC医学振興財団:SBC研究助成制度(2023年度)
■論文情報
タイトル:iPSC-derived megakaryocytes and platelets accelerate wound healing and angiogenesis
著者:Kentaro Kosaka, Naoya Takayama, Sudip Kumar Paul, Maria Alejandra Kanashiro, Motohiko Oshima, Masaki Fukuyo, Bahityar Rahmutulla, Ikuko Tajiri, Michiaki Mukai, Yoshitaka Kubota, Shinsuke Akita, Nobutaka Furuyama, Atsushi Kaneda, Atsushi Iwama, Koji Eto, Nobuyuki Mitsukawa
雑誌名:Stem Cell Research & Therapy
DOI:10.1186/s13287-024-03966-z
■参考文献
1. タイトル:Expandable megakaryocyte cell lines enable clinically applicable generation of platelets from human induced pluripotent stem cells
雑誌名:Cell Stem Cell
DOI:10.1016/j.stem.2014.01.011.
企業プレスリリース詳細へ
PR TIMESトップへ
関連記事